2021年2月12日,先聲藥業(yè)的合作伙伴G1 Therapeutics公司(以下簡稱G1公司)宣布其產(chǎn)品Trilaciclib(商品名:COSELA)獲得美國食品藥品監(jiān)督管理局(FDA)批準(zhǔn)上市,用于預(yù)防擴散期小細胞肺癌成人患者因鉑類╱依托泊苷方案或拓撲替康方案化學(xué)治療導(dǎo)致的骨髓抑制。
Trilaciclib是G1 Therapeutics公司發(fā)現(xiàn)并研發(fā)的一款“First-in-Class”小分子短效CDK 4/6抑制劑,一個化療開始前預(yù)防性給藥以保護骨髓和免疫系統(tǒng)功能的產(chǎn)品,曾經(jīng)獲得FDA授予的突破性療法認(rèn)定。
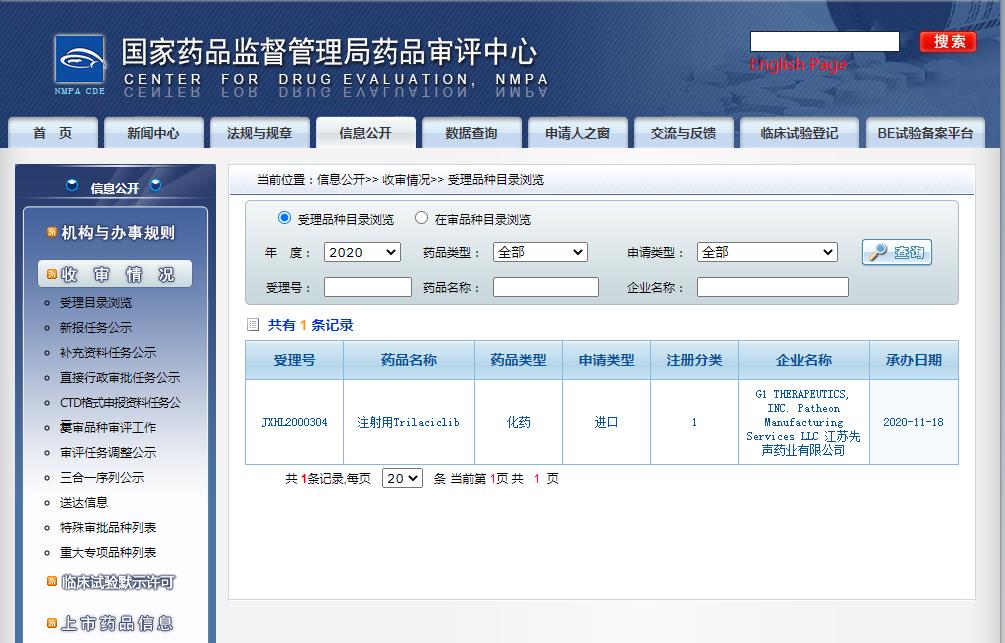
據(jù)了解,G1公司和勃林格殷格翰已于在2020年6月簽訂了戰(zhàn)略合作協(xié)議,在美國等各個市場銷售Trilaciclib。先聲藥業(yè)與G1公司于同年8月達成了許可協(xié)議,獲得了Trilaciclib在大中華地區(qū)的所有適應(yīng)癥的開發(fā)和商業(yè)化權(quán)益,并且將參與其在全球的臨床試驗。
圖片來源:CDE官網(wǎng)截圖
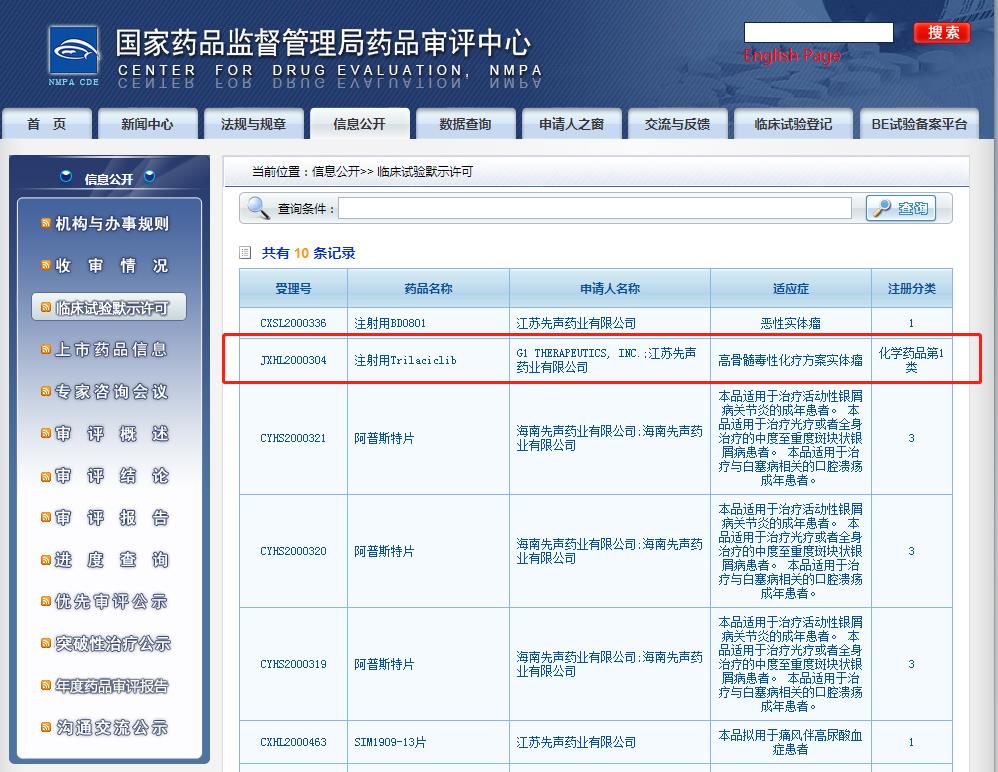
2021年1月,查看國家藥監(jiān)局藥品審評中心(CDE)網(wǎng)站公示可知,先聲藥業(yè)和G1公司聯(lián)合申報的Trilaciclib用于高骨髓毒性化療方案的實體瘤相關(guān)臨床試驗申請已獲得批準(zhǔn)。
圖片來源:CDE官網(wǎng)截圖
關(guān)于骨髓抑制
骨髓抑制是一種化學(xué)療法和某些影響免疫系統(tǒng)的藥物導(dǎo)致的嚴(yán)重副作用,是骨髓干細胞受損的結(jié)果,可引起嚴(yán)重的疾病。
人體各類血細胞(紅細胞、白細胞及血小板)的制造中心是骨髓,抑制骨髓活性很容易引起血細胞不足,從而發(fā)生嚴(yán)重后果,例如感染、貧血或自發(fā)性出血等,以至于給患者帶來一系列的負擔(dān)。
一旦發(fā)生骨髓抑制,通常需要對患者采取諸如輸注生長因子/血小板、輸血之類的搶救干預(yù)措施,并且還可能導(dǎo)致化療劑量延遲和減少,影響患者的生存獲益。
超過半數(shù)的腫瘤患者,現(xiàn)如今可能需要進行藥物治療,而化療依然是藥物治療中基礎(chǔ)的治療手段。Trilaciclib可能在在不久的將來會作為基礎(chǔ)化療手段的補充,而覆蓋廣泛的人群患者。
