2021年7月12日,國家藥品監(jiān)督管理局(NMPA)藥品審評中心(CDE)正式受理武田制藥提交的肺癌領(lǐng)域一類創(chuàng)新藥物Mobocertinib(TAK-788)上市許可申請(NDA),并獲準(zhǔn)納入優(yōu)先審評審批程序。
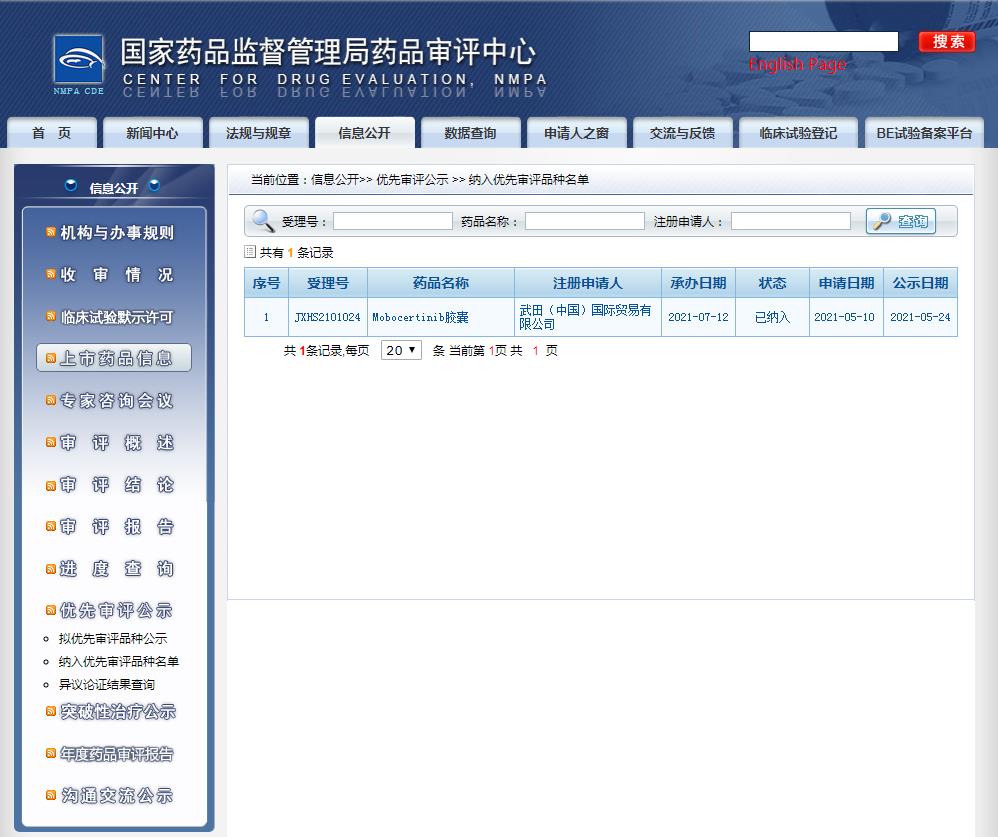
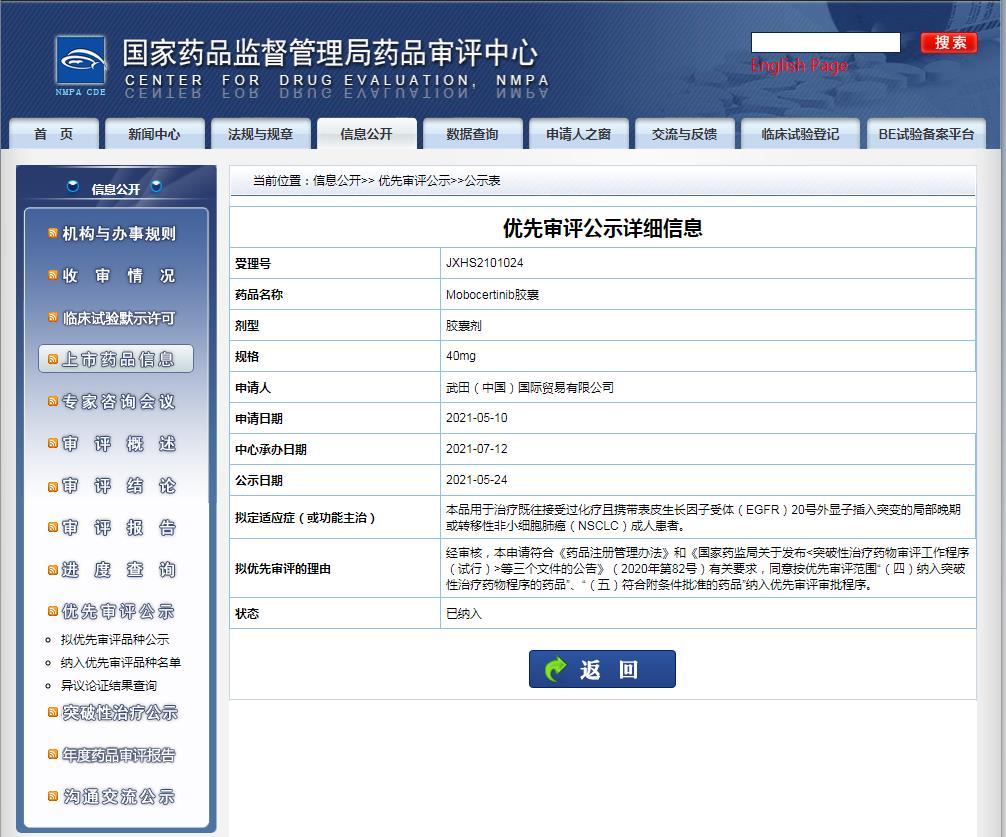
圖片來源:CDE官網(wǎng)
擬定適應(yīng)癥為:用于治療攜帶表皮生長因子受體(EGFR)20號外顯子插入突變的非小細(xì)胞肺癌(NSCLC)成人患者。
據(jù)悉,在2019年12月,美國食品藥品監(jiān)督管理局(FDA)授予Mobocertinib孤兒藥認(rèn)定;在2020年4月,獲得美國食品藥品監(jiān)督管理局(簡稱“FDA”)突破性療法認(rèn)定[1]。在今年的4月,美國FDA已授予Mobocertinib優(yōu)先審評資格,或許有可能會實現(xiàn)中國與全球的同步批準(zhǔn)。值得一提的是,國FDA于5月21日加速批準(zhǔn)Amivantamab上市,用于治療正在接受或接受過含鉑化療后進(jìn)展的局部晚期或轉(zhuǎn)移性Exon 20插入突變的成人NSCLC患者。
關(guān)于EGFR 20號外顯子插入突變
據(jù)世界衛(wèi)生組織(WHO)統(tǒng)計,全球每年新發(fā)肺癌病例約為180萬,其中非小細(xì)胞肺癌(NSCLC)大概占85%左右。
EGFR 20號外顯子插入突變是非小細(xì)胞肺癌(NSCLC)中發(fā)現(xiàn)的一種突變,在東亞地區(qū),在50%的肺腺癌患者中發(fā)現(xiàn)了EGFR激活突變。
肺癌病人EGFR突變,主要有四種類型,分別為外顯子19缺失突變,外顯子21點(diǎn)突變,外顯子18點(diǎn)突變和外顯子20插入突變,其中比較常見的EGFR突變是外顯子19缺失和外顯子21突變,二者常常被認(rèn)為是“經(jīng)典”EGFR 激活突變。
EGFR外顯子20插入(exon 20)突變在分子水平上存在異質(zhì)性,文獻(xiàn)數(shù)據(jù)顯示[2],在非小細(xì)胞肺癌 EGFR突變患者中,EGFR外顯子20插入突變的比例約為4%~10%。在國內(nèi)的所有非小細(xì)胞肺癌中,EGFR 20號外顯子插入突變發(fā)生率約占2.3%[3]。
目前,對于EGFR 20號外顯子插入突變的非小細(xì)胞肺癌病人來說,長期容易受到疾病的困擾,此外,查詢NMPA官網(wǎng),現(xiàn)在還沒有針對EGFR 20號外顯子插入突變的藥物獲批上市,所以治療的選擇十分有限,患者也因此存在未盡的治療需求。
祝賀CDE受理mobocertinib的上市許可申請,這將有望使這些患者能夠更早地獲益于此創(chuàng)新療法,惠及患者。
參考文獻(xiàn):
[1] https://www.onclive.com/view/fda-grants-mobocertinib-breakthrough-designation-for-egfr-exon-20mutant-nsclc
[2] 1. Vyse and Huang. Targeting EGFR exon 20insertion mutations in NSCLC. Signal Transduction and Targeted Therapy (2019)4:5
[3] Zhefeng Liu, Lin Wu, Jun Cao, et al. Clinical characterization of ERBB2 exon 20 insertions and heterogeneity of outcomes responding to afatinib in Chinese lung cancer patients . Onco targets and therapy
