藥品關聯(lián)審評審批政策進一步明確
為落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》(廳字〔2017〕42號),原食品藥品監(jiān)管總局發(fā)布了《關于調(diào)整原料藥、藥用輔料和藥包材審評審批事項的公告》(2017年第146號),就進一步明確原料藥、藥用料、直接接觸藥品的包裝材料和容器與藥品制劑關聯(lián)審評審批和監(jiān)管有關事宜發(fā)出相關公告。
吸入用鹽酸氨溴索溶液上市申請獲批準進口
7月11日,韓美提交的吸入用鹽酸氨溴索溶液的上市申請(JXHS1700033)獲得國家食品藥品監(jiān)督管理局批準進口,成為國內(nèi)第一個吸入劑型的氨溴索產(chǎn)品。氨溴索因為其祛痰作用而深受臨床醫(yī)生歡迎,導致注射劑被廣泛用于呼吸系統(tǒng)疾病患者的霧化治療。氨溴索在國內(nèi)醫(yī)院市場約有31億元的市場規(guī)模,其中92%都是來自于注射劑型。此次韓美入用鹽酸氨溴索溶液以【兒童用藥】的理由進入優(yōu)先審評通道,滿足了廣大兒科患者臨床需求的同時,也將對氨溴索的市場格局造成顛覆性的影響。
批準情況
本周國內(nèi)批準生產(chǎn)1項,批準進口4項。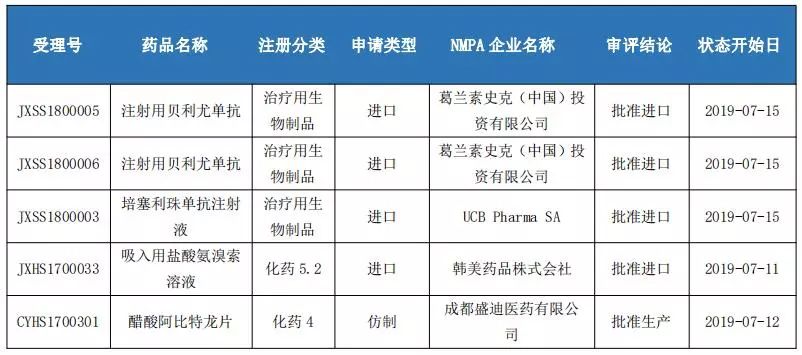

國內(nèi)申報情況
本周CDE 承辦的受理號一共135項。其中,1類新藥申請臨床10項,2 類改型新藥申請上市4項,3類仿制藥申請2項,4類仿制藥申請12 項,仿制藥一致性評價12項,境外上市化學藥品申報上市12項。生物制品申請上市4項,申請臨床2項,補充申請7項。
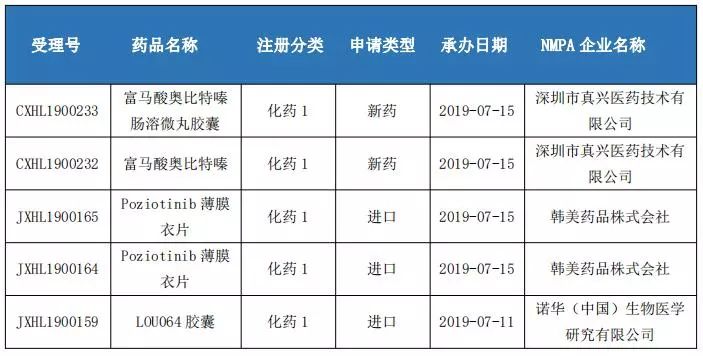
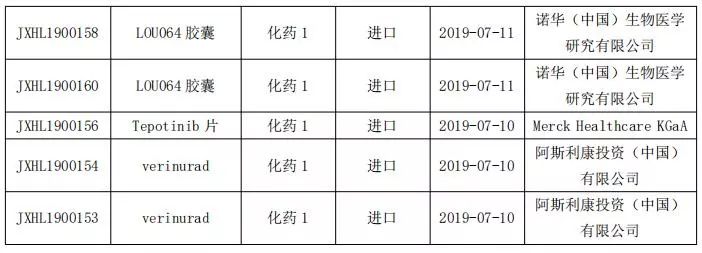
國內(nèi)1類新藥申報情況
國內(nèi)1類新藥申報情況
國內(nèi)改良型新藥申報情況
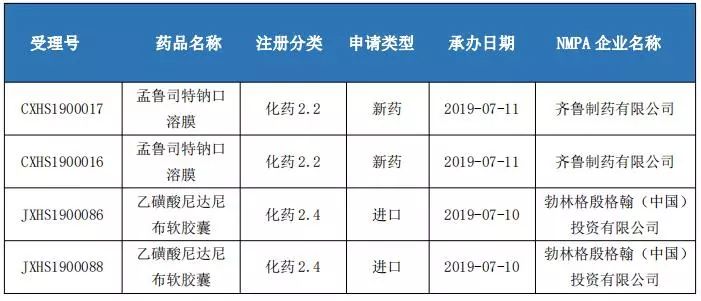
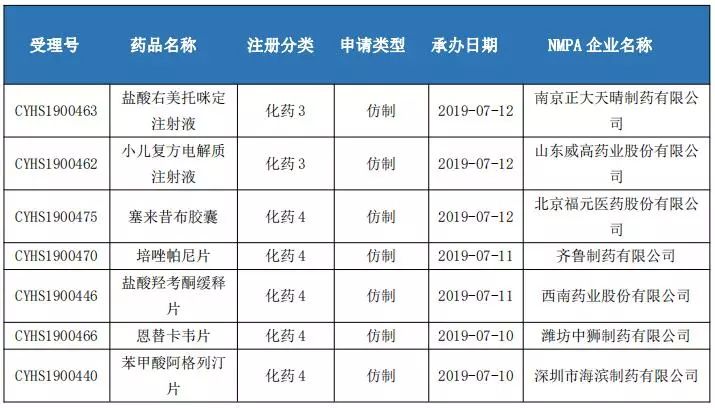
3、4類仿制藥申報情況



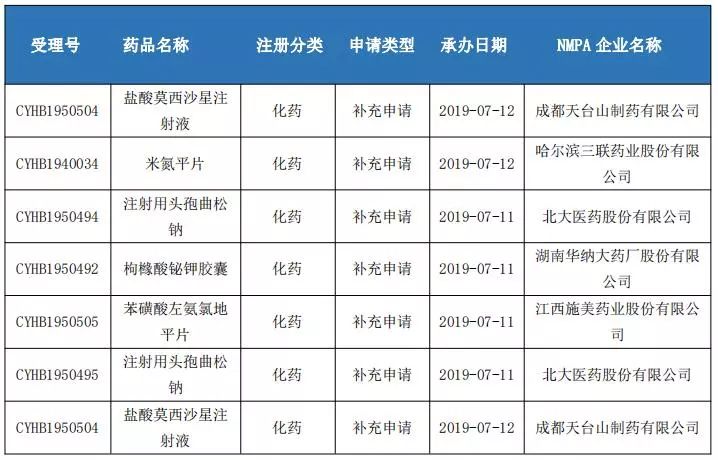
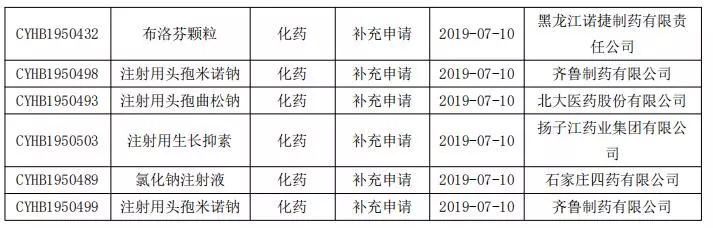
仿制藥一致性評價申報情況
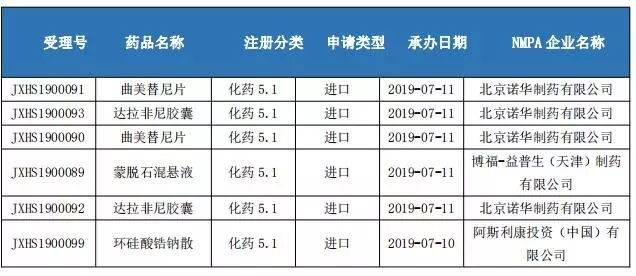
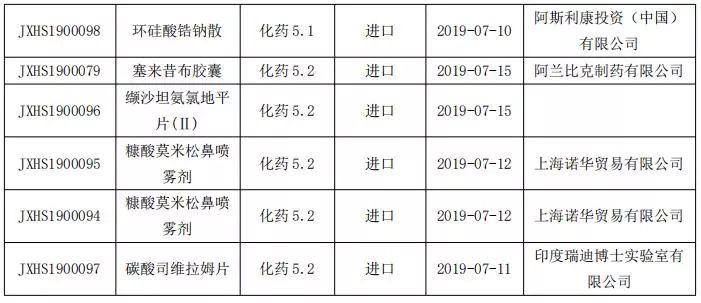
境外上市藥品申請上市情況
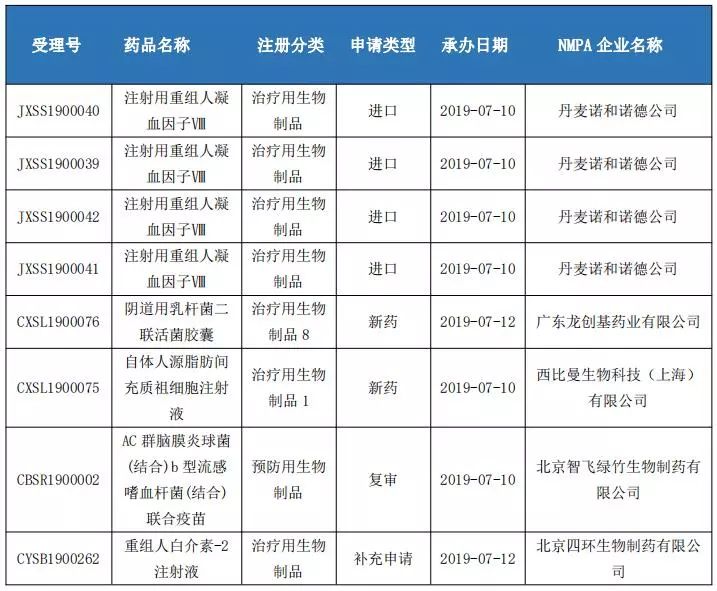
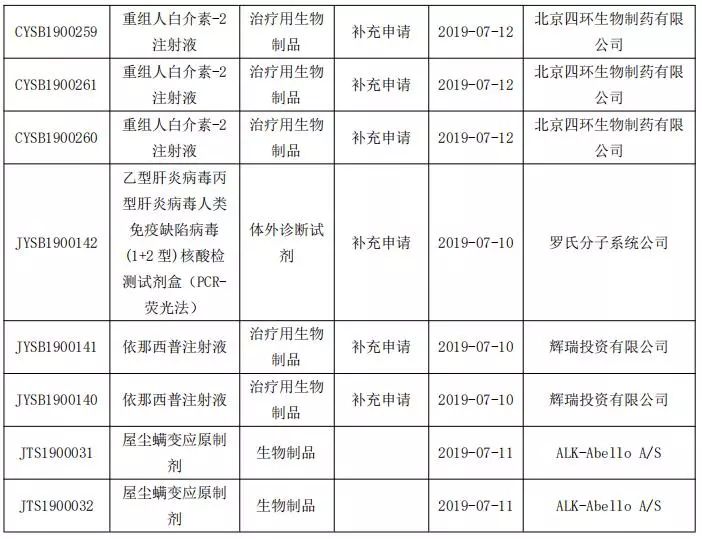
生物制品申報情況
來源:Drugfocus藥研視界
注:本文為載,僅做分享之用,對文章觀點保持中立,侵權即刪。
